Viele Protozoen leben im menschlichen Körper. Viele von ihnen sind Krankheitserreger. Unsere Geschichte handelt von zehn von ihnen, die meisten von ihnen. Die Überprüfung basiert auf historischen und aktuellen Veröffentlichungen.
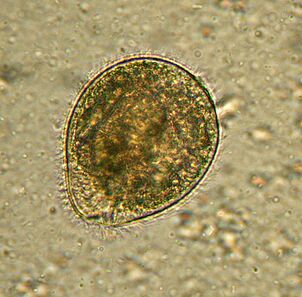
Größer. BalantidiumBalantidium coli
Das größte Protozoon ist ein menschlicher Parasit und der einzige Flimmer in diesem Unternehmen. Ihre Abmessungen variieren von 30 bis 150 Mikrometer Länge und 25 bis 120 Mikrometer Breite. Zum Vergleich: Die Länge der Malaria plasmodia im größten Stadium beträgt etwa 15 Mikrometer und ist um ein Vielfaches geringer als das Balantidium der Darmzellen, unter denen die Ciliaten leben. Ein Elefant in einem Porzellanladen.
Verteiltüberall dort, wo es Schweine gibt, deren Hauptträger. Es lebt normalerweise in der submukosalen Schicht des Dickdarms, obwohl es beim Menschen auch im Lungenepithel vorkommt. Es ernährt sich vonB. coliBakterien, Nahrungspartikeln und Fragmenten des Wirtsepithels. Bei Tieren ist die Infektion asymptomatisch. Menschen können schweren Durchfall mit einem schleimigen und blutigen Ausfluss (Balantidiasis) entwickeln, manchmal bilden sich Geschwüre an den Wänden des Dickdarms. Das Sterben an Balantidiasis ist selten, verursacht jedoch chronische Erschöpfung.
Menschen infizieren sich durch schmutziges Wasser oder zystenhaltige Lebensmittel. Die Infektionsrate beim Menschen überschreitet nicht 1%, während Schweine auf der ganzen Welt infiziert werden können.
Mit Antibiotika behandeltwurden bisher keine Berichte über Arzneimittelresistenzen dieses Ciliums veröffentlicht.
1857 vom schwedischen Wissenschaftler Malstem entdeckt. Heute ist Balantidiasis mit tropischen und subtropischen Gebieten, Armut und mangelnder Hygiene verbunden.
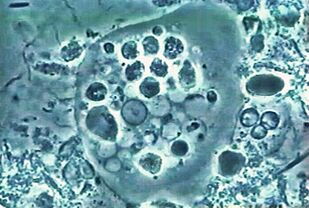
Der erste. Orale AmöbeEntamoeba gingivalis
Die erste parasitäre Amöbe, die beim Menschen gefunden wurde. Die Beschreibung der Amöben wurde 1849 in der ältesten wissenschaftlichen Zeitschrift veröffentlicht. Amöbe in Zahnbelag gefunden, daher der lateinische Name Gingiva - Zahnfleisch.
Lebtim Mund fast aller Menschen mit Zahnschmerzen oder Zahnfleischschmerzen, bewohnt Zahnfleischtaschen und Plaque. Es ernährt sich von Epithelzellen, Leukozyten, Mikroben und im Fall von Erythrozyten. Es ist selten bei Menschen mit einer gesunden Mundhöhle.
Dieses kleine Protozoon mit einer Größe von 10 bis 35 µm geht nicht in die Umwelt und bildet keine Zysten. Es wird durch Küsse, durch schmutziges Geschirr oder kontaminierte Lebensmittel auf einen anderen Wirt übertragen.E. gingivaliswird als ausschließlich menschlicher Parasit angesehen, kommt jedoch manchmal bei in Gefangenschaft lebenden Katzen, Hunden, Pferden und Affen vor.
Im frühen 20. Jahrhundert wurdeE. gingivalisals Erreger von Parodontitis beschrieben, da es in entzündeten Zahnzellen immer vorhanden ist. Die Pathogenität wurde jedoch nicht nachgewiesen.
Die Medikamente, die diese Amöbe betreffen, sind unbekannt.
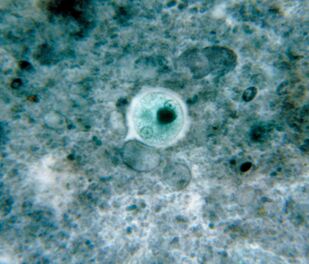
Am allgegenwärtigsten. Ruhr AmöbeEntamoeba histolytica
Dieser blutige Darmparasit dringt in das Gewebe von Leber, Lunge, Nieren, Gehirn, Herz, Milz und Genitalien ein. Sie essen, was Sie bekommen: Speisereste, Bakterien, rote Blutkörperchen, Leukozyten und Epithelzellen.
Überall verteilt, besonders in den Tropen. Im Allgemeinen infizieren sich Menschen durch das Verschlucken einer Zyste.
In gemäßigten Ländern verbleibt die Amöbe normalerweise im Darmlumen und die Infektion ist asymptomatisch. In den Tropen und Subtropen beginnt der Krankheitsprozess häufig:E. histolyticagreift die Wände an. Die Gründe für den Übergang zur pathogenen Form sind noch nicht klar, aber mehrere molekulare Mechanismen des Geschehens wurden bereits beschrieben. Daher ist es klar, dass Amöben Lyse-Substanzen absondern, durch Schleim gelangen und Zellen abtöten. Anscheinend kann die Amöbe die Wirtszelle auf zwei Arten zerstören: durch Auslösen von Apoptose oder durch einfaches Kauen an Stücken. Die erste Methode galt lange Zeit als die einzige. Übrigens wurde der Mechanismus des Zellselbstmordes nicht mit einer Rekordgeschwindigkeit in Minuten identifiziert. Die zweite Methode wurde kürzlich beschrieben, die Autoren nannten sie Trogozytose aus dem griechischen "Drei" - Nagen. Es ist bemerkenswert, dass zellbeißende Amöben ihre Beute verlassen, sobald sie stirbt. Andere können die toten Zellen vollständig verschlingen. Zellen, die beißen und essen, sollen sich im Genexpressionsmuster unterscheiden.
Nun ist die Fähigkeit der Amöbe, in den Blutkreislauf, die Leber und andere Organe einzudringen, mit Trogozytose verbunden.
Amöbiasis ist eine tödliche Krankheit. Jedes Jahr sterben rund 100. 000 Menschen an einer Infektion mitE. histolytica.
Die Ruhramöbe hat einen nicht pathogenen Zwilling,E. dispar, daher reicht die Mikroskopie nicht aus, um die Krankheit zu diagnostizieren.
Zum Heilenmuss als mobilesE. histolyticaund Zysten zerstört werden.
BeschriebenE. histolyticaund bestimmte 1875 bei einem Patienten mit Durchfall seine pathogene Natur. Der lateinische Name Amöbe wurde 1903 vom deutschen Zoologen Fritz Schaudin vergeben.Histolyticabedeutet Gewebezerstörung. 1906 starb der Wissenschaftler an einem amöbischen Darmabszess.
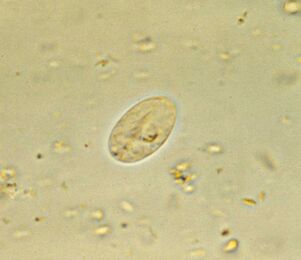
Am häufigsten. DarmlamblieGiardia lamblia (G. intestinalis)
Giardia, der häufigste Darmparasit, ist allgegenwärtig. 3-7% der Menschen in Industrieländern und 20-30% in Entwicklungsländern sind infiziert. Das sind ungefähr 300 Millionen Menschen.
Parasiten lebenim Zwölffingerdarm und in den Gallengängen des Wirts, wo sie schwimmen, mit Flagellen arbeiten und dann mit Hilfe einer klebrigen Scheibe am Boden der Zelle am Epithel haften. Für 1 cm2haftet das Epithel an einer Million Lamblien. Sie schädigen die Zotten, was die Nährstoffaufnahme stört und Entzündungen der Schleimhäute und Durchfall verursacht. Wenn die Krankheit die Gallenwege betrifft, geht sie mit Gelbsucht einher.
Giardiasis ist eine Krankheit mit unreinen Händen, Wasser und Nahrungsmitteln. Der Lebenszyklus eines Protozoen ist einfach: Im Darm gibt es eine aktive Form und am Ausgang - mit Fäkalienmassen - stabile Zysten. Um infiziert zu werden, reicht es aus, ein Dutzend Zysten zu schlucken, die im Darm wieder eine aktive Form annehmen.
Das Hauptgeheimnisder Allgegenwart von Lamblien bei der Variabilität von Oberflächenproteinen. Der menschliche Körper kämpft mit Antikörpern gegen Lamblien und ist im Prinzip in der Lage, Immunität zu entwickeln. Aber Menschen, die in der gleichen Gegend leben und das gleiche Wasser trinken, werden immer wieder von den Nachkommen ihrer eigenen Parasiten infiziert. Warum? Denn beim Übergang von der aktiven Phase zur Zyste und umgekehrt verändert Lamblia die Proteine, für die die Antikörper produziert werden: variantenspezifische Oberflächenproteine. Es gibt ungefähr 190 Varianten dieser Proteine im Genom, aber nur eine ist jemals auf der Oberfläche eines einzelnen Parasiten vorhanden, die Translation des Restes wird durch den RNA-Interferenzmechanismus gestört. Und die Änderung erfolgt ungefähr alle zehn Generationen.
Es wirdmit einem Antiprotozoenmittel mit antibakterieller Aktivität behandelt. Die Krankheit klingt innerhalb einer Woche ab, aber wenn die Gallenwege infiziert sind, können viele Jahre lang Rückfälle auftreten. Zysten werden durch Jodieren des Wassers bekämpft.
1859 vom tschechischen Wissenschaftler Vilém Lambl entdecktGiardia lamblia. Seitdem hat der einfachste mehrere Namen geändert und der aktuelle wurde zu Ehren des französischen Entdeckers und Parasitologen Alfred Giar erhalten, der Lamblia nicht beschrieb.
Und die erste Skizze von Giardia wurde von Anthony van Leeuwenhoek angefertigt, der sie auf seinem eigenen Stuhl verwirrt fand. Es war im Jahre 1681.
Übrigens ist Giardia auch aus evolutionärer Sicht sehr alt, sie stammt fast direkt vom Vorfahren aller Eukaryoten.
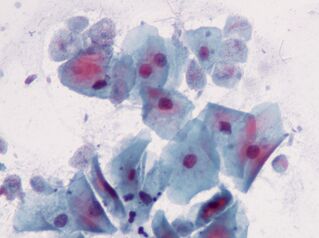
Das intimste. Trichomonas vaginalisTrichomonas vaginalis.
Die einfachste, die sexuell übertragen wird. Es lebt in der Vagina und bei Männern; In der Harnröhre, im Nebenhoden und in der Prostata wird es sexuell oder durch feuchte Tücher übertragen. Babys können sich durch den Geburtskanal infizieren.T. vaginalishat 4 Flagellen am vorderen Ende und eine relativ kurze Wellenmembran; ggf. Pseudopoden freigeben. Die maximale Größe von Trichomonas beträgt 32 mal 12 Mikrometer.
Trichomonas istweiter verbreitetals die Erreger von Chlamydien, Gonorrhoe und Syphilis zusammen. Es betrifft ungefähr 10% der Frauen und möglicherweise mehr und 1% der Männer. Diese letzte Zahl ist nicht zuverlässig, da es schwieriger ist, den Parasiten bei Männern zu erkennen.
T. vaginalisernährt sich von Mikroorganismen, einschließlich Milchsäurebakterien aus der vaginalen Mikroflora, die eine saure Umgebung aufrechterhalten und daher einen optimalen pH-Wert für sich selbst erzeugen4. 9.
Trichomonas zerstört Schleimhautzellen und verursacht Entzündungen. Etwa 15% der infizierten Frauen klagen über Symptome.
Es wirdmit einem antibakteriellen Medikament behandelt. Als vorbeugende Maßnahme wird eine regelmäßige Vaginaldusche mit verdünntem Essig empfohlen.
1836 vom französischen Bakteriologen Alfred Donne beschrieben. Der Wissenschaftler verstand nicht, dass sich vor ihm ein pathogener Parasit befand, aber er bestimmte die Größe, das Aussehen und die Art der Bewegung der einfachsten.
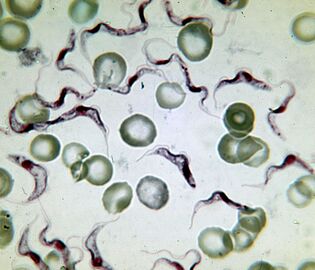
Das Tödlichste. Der Erreger der SchlafkrankheitTrypanosoma brucei
Der Erreger der afrikanischen Schlafkrankheit ist das tödlichste Protozoon. Eine infizierte Person stirbt ohne Behandlung. Das Trypanosom ist ein längliches Flagellat mit einer Länge von 15 bis 40 µm. Es sind zwei Unterarten bekannt, die anscheinend nicht zu unterscheiden sind. Krankheit verursacht durchT. brucei gambiensedauert 2 bis 4 Jahre.T. brucei rhodesienseist ein virulenterer vorübergehender Erreger, an dem sie nach einigen Monaten oder Wochen sterben.
In Afrika zwischen den 15 Parallelen der südlichen und nördlichen Hemisphäre im natürlichen Bereich des Trägers verteilt: blutsaugende Insekten der GattungGlossina(Tsetsefliege). Von den 31 Fliegenarten sind 11 für den Menschen gefährlich. Die Schlafkrankheit betrifft die Bevölkerung von 37 Ländern südlich der Sahara in 9 Millionen km Entfernung2. Jedes Jahr werden bis zu 20. 000 Menschen krank. Jetzt gibt es ungefähr 500. 000 Patienten, 60 Millionen leben in Gefahr.
Aus dem Darm der FliegeT. bruceigelangt es in den menschlichen Blutkreislauf, von dort in die Liquor cerebrospinalis und beeinflusst das Nervensystem. Die Krankheit beginnt mit Fieber und geschwollenen Lymphknoten, gefolgt von Lethargie, Schläfrigkeit, Muskelparalyse, Erschöpfung und irreversiblem Koma.
Die Letalität des Parasiten hängt mit seiner Fähigkeit zusammen, die Blut-Hirn-Schranke zu überwinden. Die molekularen Mechanismen sind nicht vollständig verstanden, aber es ist bekannt, dass der Parasit beim Eintritt in das Gehirn Cysteinproteasen sekretiert und auch einige Wirtsproteine verwendet. Im Zentralnervensystem hingegen flüchtet sich das Trypanosom vor Immunfaktoren.
Die erste Beschreibung der Schlafkrankheit im oberen Niger wurde vom arabischen Gelehrten Ibn Khaldun (1332-1406) hinterlassen. Bereits zu Beginn des 19. Jahrhunderts waren sich die Europäer des ersten Anzeichen der Krankheit bewusst - der Schwellung der Lymphknoten im Nacken (ein Symptom von Winterbottom), und die Sklavenhändler achteten besonders darauf.
EntdecktT. bruceiDer schottische Mikrobiologe David Bruce, nach dem er benannt ist, stellte 1903 erstmals die Verbindung zwischen dem Trypanosom, der Tsetsefliege und herSchlafkrankheit.
Die Behandlunghängt vom Stadium der Krankheit ab, und Medikamente verursachen schwerwiegende Nebenwirkungen. Der Parasit weist eine hohe Antigenvariabilität auf, so dass es unmöglich ist, einen Impfstoff herzustellen.
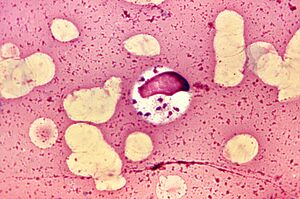
Das Extravaganteste. LeishmaniaLeishmania donovani
Leishmanien haben den Titel der ausgefallensten Parasiten erhalten, weil sie in Makrophagen leben und sich vermehren, Zellen, die zur Zerstörung von Parasiten entwickelt wurden.L. donovaniist der gefährlichste von ihnen. Es verursacht viszerale Leishmaniose, umgangssprachliches Dumdumfieber oder Kala Azar, an denen fast alle Patienten ohne Behandlung sterben. Aber die Überlebenden erwerben langfristige Immunität.
Es gibt drei Unterarten des Parasiten.L. donovani infantum(Mittelmeer und Zentralasien) betrifft hauptsächlich Kinder, Hunde sind normalerweise sein Reservoir.L. donovani donovani(Indien und Bangladesch) ist gefährlich für Erwachsene und ältere Menschen, es gibt keine natürlichen Reservoire. Der AmerikanerL. donovani chagasi(Mittel- und Südamerika) kann im Blut von Hunden leben.
L. donovani- Geißeln Sie nicht länger als 6 Mikrometer. Menschen infizieren sich, nachdem sie von Mücken der GattungPhlebotomusgebissen wurden, manchmal durch sexuellen Kontakt, Babys, die den Geburtskanal passieren. Im Blut dringtL. donovaniin Makrophagen ein, die den Parasiten durch innere Organe transportieren. Durch die Vermehrung in Makrophagen zerstört der Parasit diese. Der molekulare Überlebensmechanismus in Makrophagen ist recht komplex.
Krankheitssymptome: Fieber, vergrößerte Leber und Milz, Anämie und Leukopenie, die alle zur sekundären bakteriellen Infektion beitragen. Jedes Jahr erkranken 500. 000 Menschen an viszeraler Leishmaniose und etwa 40. 000 sterben.
Behandlungschwer: intravenöses Antimon und Bluttransfusion.
Die taxonomische ZugehörigkeitL. donovaniwurde 1903 vom berühmten Malariaforscher und Nobelpreisträger Ronald Ross bestimmt. Es verdankt seinen Gattungsnamen William Leishman und den spezifischen Namen Charles Donovan, der 1903 unabhängig voneinander Protozoenzellen in der Milz von Patienten entdeckte, die an Kala Azar starben, eine in London, die andere in Madras.
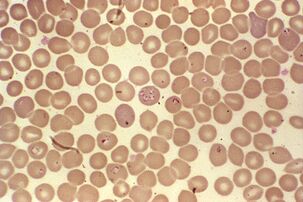
Der schwierigste Lebenszyklus.Babesia spp.
Babesien erschwerten neben der mehrstufigen asexuellen Reproduktion in Erythrozyten von Säugetieren und Sexualmilben im Darm der GattungIxodesihre Entwicklung durch transovarianische Übertragung. Aus dem Darm einer weiblichen Milbe gelangen Protozoen-Sporozoiten in die Eierstöcke und infizieren die Embryonen. Wenn die Milbenlarven schlüpfen, gelangt die Babesie in ihre Speicheldrüsen und gelangt beim ersten Biss in das Blut des Wirbeltiers.
DistributedBabesia in Amerika, Europa und Asien. Sein natürliches Reservoir sind Nagetiere, Hunde und Vieh. Eine Person ist mit verschiedenen Arten infiziert: B. microti, B. divergens, B. duncaniundB. venatorum.
Die Symptome der Babesiose ähneln denen der Malaria: rezidivierendes Fieber, hämolytische Anämie, vergrößerte Milz und Leber. Die meisten Menschen erholen sich spontan, aber Babesiose ist bei Patienten mit geschwächtem Immunsystem tödlich.
Behandlungsmethodenbefinden sich noch in der Entwicklung, während Antibiotika und in schweren Fällen Bluttransfusionen verschrieben werden.
Babesia wurde vom rumänischen Mikrobiologen Victor Babes (1888) beschrieben, der es bei kranken Kühen und Schafen entdeckte. Er entschied, dass es sich um ein pathogenes Bakterium handelte, das erHaematococcus bovisnannte. Babesia galt lange Zeit als tierischer Erreger, bis es 1957 bei einem jugoslawischen Hirten entdeckt wurde, der an einer B. divergens-Infektion starb.
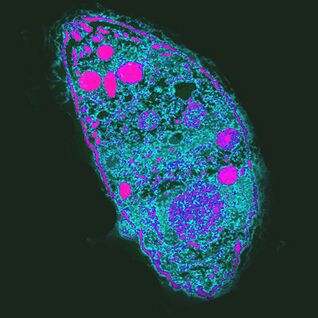
Der einflussreichste. Der Erreger der ToxoplasmoseToxoplasma gondii
T. gondiiist der stärkste Parasit, da er das Verhalten von Zwischenwirten steuert.
Überall verteilt, ungleichmäßig verteilt. In Frankreich sind beispielsweise 84% der Bevölkerung infiziert, im Vereinigten Königreich 22%.
Der Lebenszyklus von Toxoplasma besteht aus zwei Phasen: asexuell tritt im Körper von warmem Blut auf, sexuelle Fortpflanzung ist nur in den Epithelzellen des Darms der Katze möglich. ZUT. gondiikönnte die Entwicklung abschließen, die Katze muss ein infiziertes Nagetier fressen. Durch die Erhöhung der Wahrscheinlichkeit dieses Ereignisses blockiertT. gondiidie natürliche Angst der Nagetiere vor dem Geruch von Katzenurin und macht es attraktiv, indem es auf eine Gruppe von Neuronen in der Amygdala abzielt. Wie er es macht, ist unbekannt. Einer der mutmaßlichen Wirkmechanismen ist eine lokale Immunantwort auf eine Infektion. Ändert die Zytokinspiegel, was wiederum die Spiegel von Neuromodulatoren wie Dopamin erhöht. Toxoplasma beeinflusst auch das menschliche Verhalten, das sich sogar auf Bevölkerungsebene manifestiert. In Ländern mit einem hohen Grad an Toxoplasmose, Neurotizismus und dem Wunsch, Unsicherheit zu vermeiden, sind neue Situationen häufiger. Es ist möglich, dass eine Infektion mitT. gondiikulturelle Veränderungen verursachen kann.
Eine Infektionbeim Menschen ist normalerweise asymptomatisch, zerstört jedoch bei geschwächter Immunität Zellen in Leber, Lunge, Gehirn und Netzhaut und verursacht akute oder chronische Toxoplasmose. Der Verlauf der Infektion hängt von der Virulenz des Stammes, dem Status des Immunsystems des Wirts und seinem Alter ab. ältere Menschen sind weniger anfällig fürT. gondii.
Behandeln SieToxoplasmose mit Antiprotozoen-Medikamenten.
Beschrieben1908 bei Wüstennagetieren. Diese Auszeichnung gehört den Mitarbeitern des Pasteur-Instituts von Tunis, Charles Nicolas und Luis Manso.
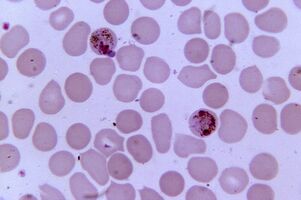
Mehr Krankheitserreger. Plasmodium malariaPlasmodium spp.
Plasmodium malaria ist der pathogenste Parasit beim Menschen. Die Zahl der Patienten mit Malaria kann 300 bis 500 Millionen erreichen, die Sterblichkeitsrate während Epidemien 2 Millionen. Die Krankheit fordert immer noch dreimal mehr Menschenleben als bewaffnete Konflikte.
Fünf Arten von Plasmodium verursachen beim Menschen Malaria:Plasmodium vivax, P. falciparum, P. malariae, P. ovaleundP. knowlesi, die ebenfalls betroffen sindMakaken.
Verteiltim Vektorbereich: MückenAnopheles, die eine Temperatur von 16–34 ° C und eine relative Luftfeuchtigkeit von mehr als 60% erfordern.
Ein Vergleich des Genoms der virulentesten Plasmodien,P. falciparum, mit den Gorilla-Plasmodien legt nahe, dass Menschen von ihrem Vorfahren dieser Affen infiziert wurden. Die Entstehung dieser Form von Plasmodium ist mit der Entstehung der Landwirtschaft in Afrika verbunden, was zu einer Zunahme der Bevölkerungsdichte und zur Entwicklung von Bewässerungssystemen führte.
Die sexuelle Vermehrung von Plasmodien erfolgt im Darm von Mücken, und im menschlichen Körper ist es ein intrazellulärer Parasit, der in Hepatozyten und Erythrozyten lebt und sich vermehrt, bis die Zellen platzen. 1 ml Blut des Patienten enthält 1 - 50. 000 Parasiten.
Die Krankheit manifestiert sich als Entzündung, wiederkehrendes Fieber und Anämie. Im Falle einer Schwangerschaft ist sie gefährlich für Mutter und Fötus. MitP. falciparuminfizierte rote Blutkörperchen verstopfen die Kapillaren und in schweren Fällen entwickelt sich eine innere Organ- und Gewebeischämie.
Die Behandlungerfordert eine Kombination mehrerer Medikamente und hängt vom spezifischen Krankheitserreger ab. Plasmodien werden resistent gegen Medikamente.






































